
 |
|
|
Главная --> Промиздат --> Абразионные материалы АЛЕКСАНДРИЙСКАЯ БУМАГА, см. Бумаги сорта. АЛЕКСАНДРИТ, минерал, разность хризоберилла (см.); зеленого цвета при дневном освещении и фиолетового при вечернем свете. Употребляется как драгоценный камень 1-го класса. Встречается в изумрудных копях на Урале. АЛЕППСКИЙ ЧЕРНИЛЬНЫЙ ОРЕШЕК, см. Дубильные вещества. АЛЕРЦОВОЕ ДЕРЕВО, Fitzroya pata-gonica. Hook fil (сем. Cupressineae), растет в горах южн. Чили; другой вид его растет в виде кустарника в Тасмании и обладает темно-красной прочной и легко раскалывающейся древесиной, употребляемой в кровельном деле и для выделки мебели. АЛЕУРОМЕТР, прибор для определения пекарных свойств муки по разбуханию ее клейковины, состоит из градуированного цилиндра, в который закладывается навеска клейковины; цилиндр подогревают в масляной ванне. Под влиянием тепла клейковина расширяется и поднимает вставленный в цилиндр поршень, по подъему к-рого на определенное число делений цилиндра судят о всхолсести клейковины: чем больше последняя, тем мука считается лучше. Известен А. Болланда. В настоящее время применяется определение диастатической силы муки (количество диастаза), которое более точно характеризует ее пекарные свойства. АЛИДАДА, линейка, вращающаяся вокруг центра круга с делениями (лимба), с указателем для отсчитывания по делениям лимба угла поворота линейки. То же название дается вращающейся верхней части угломерных приборов (теодолита, секстанта и др.), снабженной визирным прибором и приспособлениями для точного отсчитывания углов (верньерами). АЛИЗАРИН, 1, 2-диоксиантрахинон СО ОН \/\/\он или CiiHgOi, встречается в природе в виде глюкозида в зрелых корнях (кгарр, garance, madder) т.н. красильной марены (Rubia tinctorum) и ее разновидностей. Мареновые-многолетние растения с ленсачим стеблем; известны человеку как краси.чьный материал с древнейших времен (Египет, Индия, Персия, Смирна). В Леванте корень марены носил название лизари или ализари , отсюда- ализарин . В Европе красильная марена разводилась гл. обр. во Франции (близ Авиньона), а также в Эльзасе, Бельгии, Голландии (с 16 в.) и Баварии. Со второй половины 18 века марена культивировалась в Крыму и на Кавказе (Дербент, Баку), а также в Самарканде. Ко времени открытия синтетического А., т. е. к 70-м гг. прошлого столетия, мировая добьгаа маренового корня превышала 75 000 т (44 млн. п.) - соответственно 750 т (45 000 - 50 000 п.) А., на сумму 75 ООО ООО фр. Общая площадь, занятая под культуры марены, исчислялась к этому времени тысячами км*. Цена ализарина составляла в то время приблизительно 100 франков за 1 кг. В мареновом корне содержится глюко-зид А. в смеси с глюкозидом пурпурина (1, 2, 4-триоксиантрахинон), ксантонурпу-рина (1,3-диоксиантрахинон) и псевдопурпурина (3-карбоновая кислота пурпурина). Глюкозид А., т. н. рубэритриновая к-та, в чистом виде впервые получена Рохледером. Состав ее CgeHaeOi, установлен Грэбе и Либерманом. При нагревании с разведенными к-тами рубэритриновая к-та распадается на А. и глюкозу. Рубэритриновая к-та одноосновна; содержащаяся в ней биоза переходит при гидролизе в 2 молекулы глюкозы: Ci4He02(OH) . (ОС12Н21О10) + 2Н2О -> С14Нб02(ОН)2 4-2СбН120б. Естественным путем расщепление глюкозида марены происходит под влиянием содержащегося в самом корне азотистого энзима, носящего название эритрозима . Техническое выделение ализарина, более или менее свободного от пурпурина и других красящих спутников водных вытяжек маренового корня, разработано Конном. В основе метода лежит подмеченное Коппом свойство глюкозида А. расщепляться труднее сравнительно с глюкозидами пурпурина и псевдонур-пурина. Подкисленной сернистой к-той водой из свеже - измельченного маренового корня удается извлечь все красящие начала, не опасаясь потерь от преждевременного расщепления глюкозидов. При прибавлении 2 - 3% соляной кислоты и повышении t° до 60° выделяются красные хлопья пурпурина, в смеси с псевдопурпурином. Глюкозид А. количественно остается в растворе им. б. выделен дальнейшим нагреванием в виде так наз. зеленого А. . Впервые А. был выделен из краппа Робике (Robiquet) и Колэном (Colin) в 1826 г. Пурпурин выделен ими же в 1828 г. Выяснению строения А. способствовало наблюдение Шунка, получившего в 1848 г. при окислении А. к-ту, названную им ализариновой к-той, соединение, к-рое, по исследованиям Гебгардта, а затем Вольфа и Штрекера, оказалось тождественным с фталевой к-той. Вследствие этого А. стал считаться тогда производным нафталина, и ему приписывали формулу СщНеОз. В 1866 г. Штре-кер предлагает для А. формулу СцНО, но на это сообщение в то время не было обращено должного внимания. Лишь Грэбе в 1868 г., применив к А. классический метод Байера-перегонку с цинковой пылью, показал, что родоначальником А. является антрацен. Уже в январе 1869 г. Грэбе и Либерман делают знаменательное сообщение о синтезе А., исходя из антрацена, и обращают внимание на научное и техническое значение этого открытия как первого примера искусственного получения растительного красителя. Исходным продуктом для этой работы послужил англ. каменноугольный антрацен, предоставленный Мартиусом в количестве 500 г. Первоначально Грэбе и Либерман при синтезе А. исходили из дибромантрахинона, сплавлением последнего с едким кали, затем-из антрацена рядом операций: антрацен ди-бромантрацен тетрабромид тетрабром-антрацен дибромантрахинон ализарин. Синтез А. (1869 г.) в связи с быстрым технич. усовершенствованием синтетических методов свел в течение немногих лет культивирование красильной марены на-нет, освободив громадные пространства плодородной земли под другие культуры. Т. о. не только научное значение (первый синтез естественного красителя), но и практическое значение синтеза А. по своим экономическим последствиям является в истории беспримерным. Современная нам формула строения А. создалась не сразу. Из двух возможных формул строения антрацена СН СН I. ГУ и и. /\/ СН /\/\сн \/\А Грэбе и Либерман вначале склонны были отдавать предпочтение ф-ле П. Дальнейшие исследования Фиттиха и Остермайера и Грэбе вскоре показали, однако, что формула II как нельзя лучше отвечает строению фенантрена. Для антрацена оставалась т. о. лишь ф-ла I. Фиттихом же было установлено, что антрахинону следует придать строение дифенилен-дикетона *<Ссо/ *- При окислении А. образуется незамещенная фталевая кислота с.н4°>с.н.(он,.с.н/° . значит оба гидроксила молекулы расположены в одном и том же боковом ядре. На-.личие двгх гидроксильных групп явствует между прочим и из того обстоятельства, что, как показал Шютценберже, А. образует дибензоилпроизводное. Работы Гримма, Байэраи Каро, Либермана и др, устанавливают относительные положения гидроксильных групп в А., гистазарине, хинизарине и пурпурине. Строение хинизарина как 1,4-диоксиантрахинона явствует из синтеза этого соединения конденсацией фталевого ангидрида с гидрохиноном. Конденсация фталевого ангидрида с пирокатехином протекает с образованием двух изомерных диоксиантрахинонов А. наряду с гиста-зарином: ОН СО ОН /\ОИ/\/\/\ОН II.i 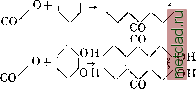 В соединении I одна из гидроксильных групп находится в положении 1, другая- в положении 2 по отношению к среднему ядру. Гидроксилы изомера II занимают положение 2 и 3. Мы знаем, что как 1-окси-, так и 2-оксиантрахинон при сплавлении со щелочами переходят в один и тот же А. СО ОН со он /\/\/\ /\/\/\он 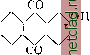 т. о. в А. гидроксильные группы должны занимать положение 1,2. Строение пурпурина как 1,2,4-триоксиантрахинона вытекает из того обстоятельства, что как А., так и хинизарин при окислении переходят в один и тот же пурпурин со он со ОН СО ОН 1\0Н /\/\/\0Н со он Строение антрапурпурина и флавонурпу-рина обусловливается строением исходных дисульфокислот антрахинона: СО СО он 80,Н/\/\/\80зН 0Н/\/\/1\0Н (антра- или изопурпурин) /\/\80зН СО он /\/\/\он 80,Н\/\/\/ он\/\/\/ со (флавоиурпурин) Метод Грэбе и Либермана синтеза А. из дибромантра-X и н о н а. Метод этот был запатентован в Англии, Франции, Пруссии, России и Америке. Задачу выработки фабричного продукта взяла на себя Баденская ф-ка, к-рой прежде всего пришлось преодолеть трудности в получении сырья (антрацена). Каро первый показал, что при нагревании антрахинона с крепкой серной к-той до 200° образуется сульфокислота, переходящая при сплавлении с едким кали в А. Почти одновременно открытие это было сделано и в Англии Перкином (W, Н, Perkin), Каро, Грэбе и Либерманом метод этот был заявлен в Англии к патенту 25 июня 1869 г., Перкином-на один день позже. В отличие от Каро, Грэбе и Либермана, получивших в главной массе моносульфокислоту антрахинона, Перкин получил дисульфокислоты, дающие при сплавлении со щелочью А. более желтого оттенка. Патенты были выданы на обе заявки. Независимо, осенью 1869 г., тот же способ поления А. был найден на ф-ке бр. Гессерт в Эльберфельде химиком Борном и, еще несколько ранее (апрель 1869 г.), химиком Ризером на фабрике М. Люциус-Брюннинг. В прусском патенте на этот метод Грэбе и Либерману было отказано, в виду того, что в их методе не было признано каких-либо существенных нововведений. Замена сульфо-группы на гидроксил силавлением ароматических сульфопроиз-водных с едкими щелочами осуществлена была незадолго до этого (1867 г.) одновременно и независимо друг от друга Кекуле, Вюрцем и Дюссором. Нафтольный щелочный плав был произведен Эл.тером в 1868 г. Другой интересный метод получения ализарина. одновременно разработанный, с одной стороны, Грэбе и Либерманом, с другой-Перкином, запатентован, последним в Англии в 1869 г., состоит в том, что образующийся нри хлорировании антрацена дихлоран-трацен при нагревании с серной кислотой переходит в дихлордисульфокислоту антрацена. Грэбе и Либерман дальнейшим нагреванием с серной к-той переводят это соединение в дисульфокислоту антрахинона, Перкин достигает того же эффекта окислением перекисью марганца. Метод этот одно время применялся технически, давая гл. обр. пользующийся большим спросом антрапур-пурин (1, 2, 7-триоксиантрахинон). Значительное улучшение получения сульфокислот антрахинона достигнуто было в 1873 г. Кохом, химиком фабрики бр. Гессерт, применившим для сульфирования высокопроцентную дымящую серную кислоту, т.н. олеум. Фабричная разработка контактного метода получения серной к-ты в первой СЁоей стадии несомненно связана с потребностью ализариновой нромышленности в олеуме. Открытие это чрезвычайно благотворно повлияло как на чистоту, так и на выходы А. Вскоре (1875 г.) тем же Кохом впервые в технику щелочного плавления введены автоклавы, применение которых понизило t° реакции плава с 200-280° до 170-180°, повысив выходы до 100-105 ч. сухого А. на исходный антрахинон (прежде Vs этого количества). Улсе с 1871 г. ализариновым фабрикам было известно, что для получения А. нужно сплавлять не дисульфо-, а моносульфокислоту антрахинона, и что дисульфокислоты в этих условиях дают не А., а смесь триоксиантрахинонов. Опубликовано это было Перкином лишь в 1876 г. Реакция идет но ур-ию: С14Н702(80зМа) + + 3NaOH -Ь О С14Н6О2 (0Na)2 + ШО + 4- Н2О. в отсутствии кислорода получается тот же А., но реакция идет с выделением водорода: Cj4H702(ONa)-f NaOH = =С14Нб02(ОКа)2 + Н2. Как это ни странно, но добавление к щелочному плаву селитры как источника кислорода было впервые применено лишь в 1874 г., на швейцарской ф-ке А. Виндшедлера и Буша. Кох (на ф-ке бр. Гессерт) с 1875 г. в качестве окис-.тителя применял хлорноватокислый калий. Современные методы выработки А. Исходным продуктом служит чистый 99-99,5%-ный антрахинон, подвергающийся сульфированию. Смотря но тому, лселательно ли получить в главной массе моно- или дисульфокислоту антрахинона, сульфирование ведут либо при более низкой, либо при повышенной t° с меньшим или большим избытком ангидрида серной К-ТЫХ20-40%-ный олеум). При сульфировании с целью получения 2-моносуль-фокислоты часть взятого в реакцию антрахинона (от 7з ДО У2) оставляют непросуль-фированной. Операцию ведут в закрытом леелезном котле, емкостью в 2 м, с паровой рубашкой и мешалкой, с приспособлением для выдавливания массы сжатым воздухом. Щелочные плавы ведутся в железных автоклавах, с мешалкой и масляной рубашкой, на 12 atm рабочего давления, емкостью до 10 и более. Железо для ализариновых автоклавов должно быть по возможности свободно от фосфора. Такие автоклавы служат десятки лет. По окончании плава в котел накачивают воду, массу выдавливают в железные разварные баки и осаждают серной к-той. Высадившийся в виде желтых хлопьев А. фильтруют через деревянный фильтр-пресс и промывают до нейтральной реакции. Хорошая серебристая соль дает А. синеватого оттенка, не требующий дальнейшей очистки. Плавы для получения антрапурпурина и флаво-пурпурина с дисульфокислыми солями ведутся в общем аналогично плаву серебристой соли, но для получения А. хорошего качества и для увеличения выходов количество едкого натра повышают приблизительно вдвое. Растворение и осаледение плава ведется, как в случае А. синеватого оттенка. Как самый А., так и флаво- и антрапурпурин обладают чрезвьгаайно интересным свойством: нри обработке известью в присутствии избытка едкой щелочи они количественно выпадают в виде кальциевых лаков, тогда как некрасящие примеси п.лава - монооксиантрахинон, изоантра- и антрафлавиновые к-ты - остаются в этих условиях в растворе в виде натриевых солей. Это позволяет вести обработку плава с регенерацией едкой щелочи при одновременном получении чистого красителя плава. Известкование флавопур-пуринового плава. 10 нагретого раствора щелочного плава флавопур-пурина, соответствующие приблизительно 300 кг А. обыкновенной желтой марки, обрабатываются 130 - 140 кг извести. Через Yz часа добавляют водой до 15 и при 70° фильтруют через железный фильтр-пресс. Полученный после промывки горячей водой темносиний 1сальциевый лак флаво-пурпурина замешивается с водой и оса-недается соляной к-той. Высадившийся фла-вопурпурин фильтруют, промывают. Выход сухого ЧХ1СТ0Г0 флавопурпурииа 220 кг. Свободный от флавопурпурииа яркокрас-ный щелочной раствор (20° В6) при охлаждении выделяет яркокрасный кристаллический антрафлавиновокислый натрий, соответственно 72 кг антрафлавиновой кислоты (см.). С целью регенерации едкого натрия остаточный щелочной раствор выпаривают сначала до 39° В6, затем отстаиванием освобождают от выпавших солей (сульфат, сульфит), после чего окончательно концентрируют до 45°В6. Такой окрашенный в красный цвет щелок содержит до 64 объемных % NaOH и вполне пригоден для ализариновых плавов. Выход обратно полученного едкого натра-около 75% на исходное количество. Метод получения А. щелочным плавом непосредственно из антрахинона вследствие плохих выходов (распад молекулы до бензойной к-ты) не получил технич. применения, несмотря на то, что получаемый т. о. А. не содерлсит примесей триоксиантрахинонов и является поэтому продуктом чрезвычайно ценным. Некоторые характерные свойства А. Как А., так и антра-и флавопурпурин возгоняются (значительные потери вследствие обугливания) в
|