
 |
|
|
Главная --> Промиздат --> Абразионные материалы получаются азотнокислые эфиры,неправильно называемые нитроглицерином, нитроклетчаткой ИТ. п. Все опыты и всю работу с азотной КИСЛОТОЙ необходимо вести в хорошо вентилируемом помеш;ении, но лучше под специальной тягой. Анализ. Для обнарунсения следов А. к. применяют: 1) дифенилэнданилодиги-дротриазол (в продаже- нитрон ); 5 или 6 капель 10%-ного раствора нитрона в 5%-ной уксусной кислоте приливают к 5-6 см исследуемого раствора, прибавив к нему заранее одну каплю h2so4: в случае присутствия заметных количеств ионов no3 выделяется обильный осадок, при очень слабых растворах выделяются игольчатые кристаллы; при 0° можно открыть при помощи нитрона даже gq qqq hno3; 2) бруцин в водном растворе; смешивают с исследуемым раствором и осторожно приливают по стенке пробирки к крепкой серной кислоте; на месте соприкосновения обоих слоев в пробирке образуется розовато-красное окрашивание, переходящее снизу в зеленоватое. Для определения количества hno3 в растворе дымящей А. к. нужно протитровать n2o4 раствором кмпо4, определить плотность жидкости ареометром и вычесть указанную в особой таблице поправку на со-дерлсание n2o4. Промыш.ленные способы добывания А. к. Добывается А. к. гл. обр. из селитры. Раньше добывание селитры велось в т. н. селитряницах (sal-petriere), или буртах , где, в результате перемешивания навоза, мочи и т. п. со старой штукатуркой,постепенно, отчасти благодаря действию бактерий, происходит окисление мочевины и других органических соеди- Таблица уд. !. HNO- различной концентра-ц и и (по Л у н г е). Градусы В 10 О весовых частях I Iкисло- N.Os ! hno3 ! ты 1 40-Вё В 1 л (в килограммах) 060 090 120 8,0 11,9 15,4 185 i22,5 220 255 290 320 345 375 400 410 420 450 500 510 520 26,0 29,3 32,4 35,0 37,0 39,4 41,2 42,0! 42,7 44,8 48,1 48,7 49,4 84 90 100 102 104 9,15 13,31 17,34 25, 83 30,24 34,7 8 39, 39 4 3,47 4 7,08 51 ,69 55,97 57, 86 59, 83 66,24 80,6 5 84,09 85.44 10.68 15; 53 20,23 30, 13 35,28 40,58 45,95 50,71 54,93 60, 30 65, 30 67,50 69, 80 77,28 94 ,09 9 8,10 99,67 0,097 0,145 0,195 0,306 0,369 0,437 0,508 О, 573 0,633 97,3810,711 17,25 25,08 32,67 48,66 56, 16 65, 54 74,21 81,90 88,71 105,46 109,01 112,73 124,81 151,99 158,4 3 160,97 0,783 0,816 О, 849 0,961 1,210 1,270 1,299 0,113 0,169 0,227 О, 357 0,430 0,509 0,593 0,669 0,739 О, 829 914 952 991 121 411 481 515 нений азота (амины, амиды и т. п.) в А. к., образующую с известняком кальциевую се-.литру. В л-саркие дни, особенно на юге (напр. в Индии и в Ср. Азии), процесс идет очень быстро. Во Франции в 1813 г. добывали из селитряниц до 2 ООО ООО кг селитры. 25 крупных животных дают около 500 кг селитры в год. В некоторых местностях, с основной почвой, богатой ллшотными остат- ками (напр. Кубанская область), возможно наличие в почве заметного, но недостаточного для добывания, количества селитры. Заметные количества добывались в долине Ганга и находятся в наших средне-азиатских крепостях, где запасы содержащей селитру почвы доходят до 17 ш в каждом месте, но содержание в ней селитры не больше 3%. Залелш натриевой селитры - чилийской- были открыты в 1809 г.; они находятся преимущественно в провинции Тарапака, между 68° 15 и 70° 18 в. д. и 19° 17 и и 21° 18ю. ш., по встречаются и южнее и севернее (в Перу и в Боливии); месторождение их расположено на высоте 1100 м над уровнем моря. Залеяш имеют протяжение ок. 200 км дл., 3-5 км шир., содержание NaNOgB среднем 30-40%. Запасов, принимая ежегодный рост потребления в 50 000 т, может хватить на 300 лет. В 1913 г. вывезено 2 738 ООО т, но вывоз в Европу несколько уменьшился, хотя, после очень заметного падения вывоза во время войны, он снова несколько повысился с 1920 г. Обычно сверху лежит костра (50 сж - 2м толщ.), состоящая из кварцевого и полевошпатового песка, а под ней калихе (25 см - 1,5л ), содержащая селитру (залежи находятся в пустыне рядом с залежами соли и борнокаль-циевой соли). Состав калихе очень разнообразен; в нем NaNOs-от 30% до 70%, йодистых и йодноватых солей-до 2%, хлористого натрия -16-30%, сернокислых солей-до 10%, магниевых-до 6%. Лучшие сорта содержат в среднем: NaNOs-50%, NaCl-26%,Na2S04-6%, MgSO.-3%. Растворение NaNOs ведется при высокой t°, чтобы в раствор перешло гораздо больше NaNOg, чем NaCl, растворимость к-рого незначительно увеличивается с t°. Из 3 т калихе получается 1 т сырой селитры со средним содерланием 95- 96% селитры. Из 1 л маточного рассола обычно получается 2,5 - 5 г иода. Обычно сырая селитра бурого цвета, из-за примеси окиси железа. Для удобрения применяют селитру, содержащую до 1-2% хлористых соединений. Чистый азотнокислый натрий бесцветен, прозрачен, не гигроскопичен, если не содержит хлористых соединений; кристаллизуется в кубах. Для получения А. к. селитру нагревают с серной кислотой; взаимодействие идет по ур-ию: NaNOg + h2so4 = hno3 + NaHSO, т. е. получают кислый сульфат. Последний можно применить для добывания хлороводорода прокаливанием смеси NaHSO, и NaCl в муфелях. Для взаимодействия по уравнению 2 NaNO, -f I-lso4 - Na.,S04 + 2hno3 170 98 142 126 теоретически необходимо взять на 100 кг NaNOg 57,6 кг h2so4 или 60 кг кислоты 66° Вё. В действительности, во избежание разложения, серной к-ты берут на 20-30% больше. Взаимодействие ведут в горизонтальных цилиндрических железных ретортах 1,5 Л1 длины, 60 см диам., со стенками
0,182 0,27 3 0,366 О, 577 0,695 0, 822 0,957 1,080 1,193 1,339 1,476 1, 537 1,600 1,810 2,278 2, 392 2,447 в 4 см толщ. В каледый цилиндр входит 75 кг селитры и 75 кг H2SO4. Пары проводят сначала через керамиковый холодильник, охла-Лчдаемый водой, или через наклонную керамиковую трубу, потом через поглотители: баллоны или бонбоны , т. е. большие керамиковые вульфовы склянки . Если взята серная кислота 60° В6 (71%) и в первый поглотитель помещено 4 кг воды на 100 кг селитры, то получится кислота в 40 - 42° Вё (38 - 41%); применив кислоту в 66° Вё (99,6%) и сухую селитру, получим 50° Вё (53%); для получения кислоты в 36° Вё, в первый поглотитель помещают 8 л воды, во второй - 4 л, а в следующие по 2,6 л. Дымящую А. к. получают, действуя на селитру вдвое меньшим количеством серной кислоты, чем следует по расчету. По этому способу получается кислота, загрязненная хлористым нитрозилом и другими веществами, отходящими в начале процесса, и окислами азота - в конце отгонки. Окислы азота сравнительно легко отогнать, продувая через кислоту ток воздуха. Гораздо выгоднее работа в ретортах, охватываемых со всех сторон огнем и имеющих снизу трубу для выпуска бисульфата, содержащего заметное количество кислоты. Дело в том, что чугун не разъедается кислотой, если он достаточно нагрет и если соприкосновение огнем со всех сторон гарантирует от осансде-ния капель кислоты. В подобных ретортах (1,20 шир. и 1,50 jn диам., со стенками в 4-5 см толщ.) селитру обрабатывают серной кислотой из расчета 450 кг и даже 610 кг селитры на 660 кг HgSO* (66° Вё). Вместо баллонов теперь часто применяют вертикальные трубы или соединяют эти трубы с баллонами. По способу Гутмана разложение производится в чугунных ретортах, составленных пз нескольких частей (фиг. 1 и 1а); части со-  единены замазкой, состоящей обычно из 100 ч. железных опилок, 5 ч. серы, 5 ч. хлористого аммония с возможно малым количеством воды; реторты и, по возможности, загрузочный люк заключены в кирпичную гсладку и нагреваются печными газами. В реторту загружают 800 кг селитры и 800 кг 95%-ной серной кислоты и ведут перегонку 12 час; при этом тратится ок. 100 кг угля. Применяются также и цилиндрические реторты. Выделяющиеся пары попадают сначала в баллон 8; затем проходят ряд керамиковых труб, 12 и 13, помещенных в деревянный короб с водой; здесь пары сгущаются в А. к., которая сте- Фцг. la. чугунная реторта кает по трубам 22 установки Гутмана. Я 23 В сборник 28, сюда же попадает и конденсат из баллона 8; не сгустившаяся в трубах 12 А, к. попадает через 15а в башню, заполненную шарами и омываемую водой; последние следы кислоты, не поглощенные в башне, улавливаются в баллоне 43а; газы же через трубу 46а уносятся в дымовую трубу. Для окисления образующихся при перетопке окислов азота к газам непосредственно при выходе из реторты примешивается воздух. Если в производстве применяется крепкая серная кислота и высушенная селитра, то получается бесцветная 96-97%-ная А. к. Почти вся кислота конденсируется в трубах, лишь малая часть (5%) поглощается в башне, давая 70%-пую А. к., которую прибавляют к следующей загрузке селитры. Т. о. получается бесцветная А. к., 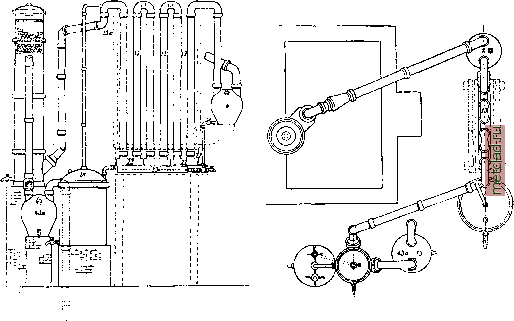 Фиг. 1. Получение азотной кислоты из селитры (установка Гутмана). лишенная хлора, с выходом в 98-99% от теории. Способ Гутмана получил большое распространение в виду простоты и дешевизны установки. Из селитры добывают 96-100%-ную кислоту по способу Валентинера, перегонкой под уменьшенным давлением (30 мм) в чугунных ретортах смеси из 1 000 кг NaNOg, 1 ООО кг H2SO4 (66°Ве) и такого количества слабой кислоты HNO3, чтобы с ней ввести 100 кг воды. Перегонка идет 10 час, при чем все время вводится воздух в сплав. Взаимодействие идет при 120°, но в конце пронесса происходит кризис (1 час) и возможны сильные толчки (при 120-130°). После этого нагрев доводится до 175-210°. Весьма важно правильное сгушение и улавливание к-ты. Пары из реторты поступают в баллон, из него в 2 сильно охлаждаемых з.меевика, из них в сборник (типа вульфовой склянки), за ним снова поставлен змеевик и дальше 15 баллонов, за которыми помещен насос. При 1 ООО кг загрузки NaNOj в 6-8 ч. получается 600 кг HNO, (48° Вё), т. е. 80% от нормы. Для получения А. к. из норвежской селитры (кальциевой) последнюю растворяют, добавляют крепкую А. к. и примешивают серную кислоту, после чего отфильтровывают азотную кислоту от гипса. Хранение и упаковка. Для хранения А. к. можно применять стеклянную, шамотовую и чисто алюминиевую (не больше 5% примесей) посуду, а также посуду из специальной кремнистой кислотоупорной стали Крупна (V2A). Т. к. при действии крепкой А. к. на дерево, опилки, тряпки, смоченные растительным маслом, и т. п. В03.М0ЖНЫ вспышки и пожары (напр., если лопнет бутыль при перевозке), то перевозить А. к. можно лишь в специальных поездах. Особенно легко при нагревании вспыхивает скипидар при попадании в крепкую А. к. Применение: 1) в виде солей для удобрения, 2) для получения взрывчатых веществ, 3) для получения полуфабрикатов для красящих веществ, а отчасти и самих красителей. Гл. обр. применяются соли А. к. или селитры (натриевая, аммонийная, кальциевая и калийная) для удобрений. В 1914 г. мировое потребление азота в виде чилийской селитры достигало 368 ООО шив виде А. к. из воздуха-10 ООО т. В 1925 г. потребление должно было дойти до 360 ООО т А. к. из воздуха. Потребление А. к. сильно возрастает во время войны в виду траты на взрывчатые вещества, главными из к-рых являются нитроглицерин и нитроклетчатки разных типов, нитросоединения (нитротолуол, тротил, мелинит и т.д.) и вещества для запалов (гремучая ртуть). В мирное время А. к. тратится на добывание нитросоединений, напр. нитробензола, для перехода к красителям через анилин, получающийся из нитробензола восстановлением. Значительное количество А. к. применяется для травления металлов; соли А. к. (селитры) применяются для взрывчатых веществ (аммонийная селитра-в бездымных, калийная-в дымных порохах) и для фейерверков (бариевая селитра-для зеленого цвета). Стандарт азотной кислот ы. Стандарт А. к. существует пока только в СССР и утвержден Комитетом по стандартизации при СТО в качестве общесоюзного обязательного стандарта (ОСТ-47) для кислоты в 40° Вё. Стандарт устанавливает содержание HNO, в А. к. в 61,20% и ограгга-чивает содержание примесей: серной кислоты не более 0,5%, хлора не более 0,8%, железа не более 0,01%, твердого остатка не более 0,9%; стандартная А. к. не должна содерлшть осадка. Стандарт регулирует взаимоотношения продавца и покупателя, жестко регламентируя методику отбора проб и производства анализов. Содержание А, к. определяется прибавлением к кислоте NaOH и обратным титрованием кислотой. Содержание серной кислоты определяется в виде BaSOi осаждением BaClg. Содержание хлора определяют титрованием в щелочной среде азотнокислым серебром. Содержание железа определяют осаждением полуторных окислов аммиаком, восстановлением окисного железа в закисное и последующим титрованием КМПО4. Упаковка А. к. не носит пока стандартного характера. Не касаясь размера, веса и качества тары, стандарт обусловливает упаковку А. к. в стеклянную посуду и дает указания, как ее упаковывать и закупоривать. Получение азотной кислоты. I. Из воздуха. Синтез А. к. из воздуха при действии вольтовой дуги повторяет до известной степени процесс, совершающийся в природе под влиянием разрядов атмосферного электричества. Кавен-диш первый наблюдал (в 1781 г.) образование окислов азота при горении Hg в воздухе, а затем (в 1784 г.) и при проскаки-вании электрической искры через воздух. Мутман и Гофер в 1903 г. первые попытались изучить равновесие: Ng-fOj 2N0. Пропуская через воздух вольтову дугу переменного тока в 2 000-4 000 V, они практически добились концентрации N0 от 3,6 до 6,7 объемн. %. Расход энергии на 1 кг HNO, у них достигал 7,71 kWh. Это равновесие изучал затем Нернст, пропуская воздух через иридиевую трубку. Далее в том же направлении работали Нернст с Елли-неком и др. исследователи. Путем экстраполирования экспериментальных результатов исследования равновесия между воздухом и окисью азота Нернсту удалось вычислить, что в правой части ур-ия устанавливается при t° 3 750° (т. е. прибли-зительно при t° вольт, дуги) содержание 7 объемных % N0. Приоритет идеи технического использования вольтовой дуги для фиксации атмосферного азота принадлежит фрапц. исследовательнице Лефебр, которая еще в 1859 г. запатентовала в Англии свой метод получения А. к. из воздуха. Но в то время стоимость электрич. энергии была слишком высока, чтобы метод Лефебр мог получить практическое значение. Следует указать enie на патенты Мак Дугаля (Ан. П. 4 633, 1899 г.) и на осуществленный в техническ. масштабе метод Bradley и Lovejoy, эксплоа-тировавшийся в 1902 г. американской фирмой Atmospheric Products С° (с 1 млн. долл. капитала) с использованием энергии
|