
 |
|
|
Главная --> Промиздат --> Абразионные материалы Периодические изменения А. п. бывают двух родов: а) с у т о ч н ы е, представленные кривыми на фиг.-2: сплошной линией - для зимнего времени, пунктирной - для летнего; влияние длины волны на ход этой периодичности незначительно; от местности 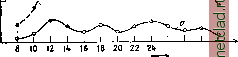 2 Б а время cymot< Фиг. 2. Суточные колебания А. н.: кривая а - зим- НИИ тип, кривая b - летний тип. последняя также почти не зависит; б) г од о в ы е, независяшие от длины волны и местности и характеризующиеся (подтвер-лодено наблюдениями в Сев. Америке и1ер-мании) кривыми на фиг. 3: сплошная линия- для наблюдений в 15 часов, пунктирная- в 9 час; J-интенсивность А. п. Определение направления А. п. может производиться обычными технич. пеленгаторами, предпочтительно односторонними. Путем таких исследований выяснилось, что, например: 1) очаг А. п. для Сев. Америки лежит в Мексике, для Зап. Европы- в европейской части СССР (особенно в летние месяцы); 2) существуют суточные и 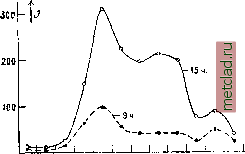 ЯФМАМ-ииА сонм -* месяцы toia Фиг. 3. Годовые колебания А. п. годичные периодические изменения направления А. п.; чащевсего в утренние часы направление главных А. п. лежит в плоскости север - юг, в то время как около полудня это направление склоняется к востоку; 3) летом А. п. почти всегда имеют резко вы-рансенное направление; 4) существует целый класс А. п. (в том числе все названные первой категорией - см. выше треск ), не имеющих направления. Изучением самого процесса разряда атмосферного электричества занялись лишь в последние годы, при чем наблюдения производились помощью трубки Брауна и специальных электронных осциллогра- фов (см.). В результате наблюдений найдены две группы атмосферных разрядов: а) апериодические - средняя продолжительность их 3,1.10 ск, и б) периодические, со средним временем 1,9,10 ск. Формы кривых атмосферных разрядов в функции времени представлены на фиг. 4, При коротковолновом приеме А. п, значительно меньше, чем, отчасти, и объясняются успехи радиосвязи на таких волнах (3,5 до 100 м). При коротких волнах характер А. п, таклсе несколько меняется: они становятся резче и более кратковременньшси: почти совершенно пропадает наиболее затрудняющая радиоприем третья категория (см, выше) А. п.; нет резкой разницы в распределении А, п. по часам суток; только после захода солйца число А, п, увеличивается, Оста.71ьные зависимости А, п, при коротких волнах пока еще не выяснены. Математически А. п, могут быть представлены в виде интеграла Фурье, охватывающего весь спектр частот, в котором д, б. все длины волн от нуля до бесконечности. Т. о. 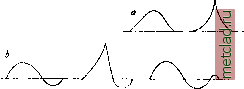 Фиг. 4. Формы отдельных А. п.: а - апериодические, Ь - периодические. при определенной настройке на волну сигнала приемной радиостанции всегда существует энергия помехи, соответствующая данной настройке; поэтому трудно избавиться от А, п ибо с достинсением ослабления А. п. уменьшается одновременно и принятая энергия от сигнализирующей радиостанции. Лит.: Шулейкин М., Курс радиотехн., М., 1923; К о е г t 8 А., Atmosphar. StOrungen in der draht-losen Nachrichtenilbermittlung, В., 1924. В. Баженов. АТМОСФЕРНЫЙ РАЗРЯД. Когда напряженность электрического поля в атмосфере превышает известные пределы, то начинается разряд электричества в атмосфере, сопровождаемый световыми явлениями. Бурный разрад называется молнией. Предположения о колебательном разряде молнии недостаточно обоснованы, но во всяком случае изменение силы тока происходит чрезвычайно быстро. Косвенные измерения дают возможность оценить электрич. напряжение при атмосферных разрядах в сотни миллионов вольт. Это указывает на необходимость защиты зданий (см. Громоотводы) и электрических проводов, А. р, в технике связи см. Беспроволочная связь и Атмосферные помехи. АТОМНАЯ ДИСПЕРСИЯ, см. Дисперсия. АТОМНАЯ РЕФРАКЦИЯ, см. Рефракция. АТОМНАЯ ТЕОРИЯ считает, что все тела состоят из отдельных тождественных друг другу частиц, называемых мо л е кула ми которые в свою очередь состоят из еще более мелких частиц - атомов. Молекулы находятся в непрерывном движении, сталкиваются друг с другом и своим движением обусловливают тепловую форму энергии, воспринимаемую организмом. Средняя скорость движения- молекул тела пропорциональна квадратному корню из его Т°. Средний свободный пробег молекулы приблизительно обратно пропорционален плотности тела (см. Кинетическая теория). Даже при низкой t° скорость теплового двюкения молекул громадна по сравнению с их размерами; молекула газа пролетает расстояние, равное своему диаметру, за промежуток времени порядка 10~* ск. Среднее расстояние между молекулами газа при нормальных условиях paj3H0 ок. 3,3.10~ см. При этих условиях молекулы занимают только 0,001 пространства, занимаемого газом. Расстояние между молекулами раз в десять больше их поперечника. Это расстояние изменяется обратно пропорционально кубическому корню из давления газа. Однако и в твердых телах расстояния мелсду молекулами довольно значительны.-Слово атом значит неделимый . Атом представляет собой мельчайшую частицу материи, которая до последнего времени считалась неразложимой на основные части. Масса отдельного атома ничтолсна; так, напр., масса водородного атома равна 1,65.10 * г. Поэтому массу атомов измеряют в относительных единицах, принимая условно массу молекулы кислорода = 16. Масса атома, выраженная в этих единицах, называется атомным весом или, правильнее, атомной массой данного веш;ества. Молекулярным весом данного тела называется сумма ат. весов всех элементов, из которых составлена данная молекула. В связи с этим определением, граммолеку-л о й данного тела называют такое количество вещества, масса которого, выралеен-ная в граммах, численно равна его молекулярной массе. В каждой молекуле может заключаться только целое число атомов. Поэтому массы, приходящиеся в хим. соединении на долю отдельных элементов, не м. б. произвольными, но относятся между собой, как чрюла, кратные ат. .весам этих элементов. Это и есть закон кратных отношений, или закон Дальтона. Кинетическая теория газов приводит к заключению, что в равных объемах всех газов при одинаковых условиях t° и давления содержится одно и то же число молекул. Это заключение называется законом Авогадро, который можно формулировать так: грамме леку ла любого газа при одинаковом давлении и одинаковой t° занимает один и тот же объем. Следовательно в граммолекуле любого газа заключается одинаковое число молекул. Оно называется числом Авогадро (N). Тщательные измерения, построенные на самых разнообразных опытах, дали для этого числа значение = 6,06.10*. Граммолекула любого газа занимает при 760 мм и при 0° объем в 22,4 л. В 1 см любого газа заключается при этих условиях 2,77.10 молекул (ч и с-ло Лошмидта, обозначаемое iVo). Чрезвычайно важным оказалось распространение закона Авогадро на растворы: при одинаковых объеме и t° растворы, имеющие одинаковое осмотическое (см. Осмос) давление, содержат одинаковое количество молекул растворенного вещества. Пользуясь этим законом, удалось определить молекулярный вес тел, к-рые трудно было бы получить в газообразном виде. Определение ат. массы твердых тел м. б. произведено на основании закона Д ю л о н г а и П т и, по к-рому ат. теплоелшость твердых тел (произведение ат. массы на удел, теплоемкость) для всех хим. элементов равна 6,4. Этот закон получил в настоящее время теоретическое обоснование, однако он имеет только приближенное значение. Атомные массы всех известных элементов но данным интернациональной комиссии приведены в Справочнике важн. физ., хим. и технолог, величин . Сокращенные обозначения атомов составлены из одной или двух букв их латршского названия. Все тела образованы из атомов хим. элементов путем соединения этих атомов в молекулы, к-рые построены либо из атомов одного и того же элемента (простые тела), либо из атомов двух или многих элементов (химические соединения). Иногда каждая молекула хим. соединения содерлсит в своем составе десятки и даже сотни атомов. Такие слоненые молекулы встречаются в органич. соединениях. Даже тлея одинаковый хим. состав и формулу, те.ла могут обладать различными физ. свойствами, что объясняется различным пространствен, распололеением атомов в молекуле. Структуру молекул и пространственное расположение атомов изучает стереож?/-мия (см.). Мощным орудием для исследования структуры молекул явился рентгеновский анализ. Первые попытки обнарулсить преломление или дифракцию рентгеновских лучей не удались. Это и не удивительно, ибо д.тина волны рентгеновских лучей- порядка 10~® СЛ1. Понятно, что самая тонкая дифракционная решетка (см. Дифракция) была слишком грубой для столь коротких волн. Лауэ пришла в голову мысль воспользоваться естественной пространственной решеткой, кристаллом, у к-рого отдельные атомы правильно расположены в простф.нстве на расстоянии друг от друга порядка 10~ см. Пропуская рентгеновские лучи через кристаллы, Лауэ удалось получить интерференцию (см.) этих лучей, но только не в виде полос, а в виде правильно расположенных пятен. Открытие Лауэ, подтвердившее атомную структуру кристаллов, дало вместе с тем возмолсность анализировать спектр рентгеновских лучей и, наоборот, просвечиванием при помощи лучей определенного спектра исследовать структуру различных тел. Строение атома. Уже давно накоплялись признаки, находившиеся в противоречии с неделимостью атомов. Электропроводность жидкостей (см. Элект,ролиз), ионизация газов, радиоактивные излучения (см. Радиоактивность) - все эти явления и привели к 10й мысли, что атомы построенц . из электрич. частиц. Применение катоднш ламп (см.) основано на испускании раскаленными телами атомов электричества - электронов. Масса одного электрона=0,903 .10~ г] т. е. приблизительно в 1 800 раз меньше массы атома водорода. Электрон имеет отрицательный заряд, равный 1,591.10~ кулонов. Заряд электрона т. о. = 1,769.10~* кулоиов на г. Кроме отрицательных элемен-тарн. зарядов, существуют еще равные им положительные зар.яды, но они более тесно связаны с массой атома. Масса водородного атома, заряженная одним пололсительным зарядом, называется протоном. По современным воззрениям каждый атом представляет собою планетную систему, в центре которой помещается ядро, состоящее из протонов, при чем в строения ядра иногда кроме протонов могут принимать участие несколько электронов. Вокруг ядра, имеющего всегда положите,т1Ьный заряд, вращаются электроны, притягиваемые к ядру по закону Кулона, подобно тому как планеты притягиваются к солнцу по закону Ньютона. Разница только та, что электроны взаимно отталкиваются, тогда как планеты притягиваются друг к другу. В нейтральном атоме число электронов, вращающихся вокруг ядра, равно разности между числом протонов и числом электронов в ядре, т. е. в точности компенсирует результирующий пололсительный заряд ядра. Однако атомы могут с большей или меньшей легкостью отдавать или принимать электроны, превращаясь в заряженные атомы, которые называются ионами. Если у них нехватает электронов для компенсации заряда ядра, то это-ионы нололштельные; если у них электронов больше, чем требует заряд ядра, то это-ионы отрицательные. Простейшим является атом водорода, состоящий из одного протона, вокруг которого вращается один электрон. Если каким-либо способом отклонить этот электрон с его пути, то останется положительно заряженное ядро - ион водорода или протон. Следующим по слолсности является атом гелия. Его ядро состоит из четырх протонов и двух электронов и имеет, т. двойной положительный заряд. Ат. в. гелия равен 4, тогда как он должен был бы равняться учетверенному ат. в, водорода, т. е. 4,03. Уменьшение ат. в. гелия объясняется излучением энергии при уплотнении четырех протонов и двух электронов в одно ядро: по теории относительности (см.) масса тела пропорциональна заключенной в нем энергии. Т.о. излучению энеогии Е соответствует потеря в массе Ат АЕ по ф-ле Ат=-, где с=3.10 см/ск. При образовании атома гелия излучается гро-мадрюе количество энергии; этим объясняется чрезвычайная устойчивость атома гелия. Ядро гелия имеет двойной пстожительный заряд. Поэтому в нейтральном атоме гелия вокруг ядра вращаются два электрона. Если удалить эти два электрона, то получится ион гелия с двумя свободными положительными зарядами. Этот ион гелия получил название -частицы. Такие частицы излучаются радиоактивными телами (см. Радиоактивность). Еще более слолсным является атом лития, состоящий из ядра с тремя свободными положительными зарядами. Вокруг этого ядра вращаются три электрона. Остальные элементы имеют еще более сложную структуру. Так, например, в нейтральном атоме железа вокруг ядра вращаются 26 электронов, а в атоме тория 90 электронов. Так. обр. орбиты электронов в сложньгх атомах образуют весьма запу-та1шую систему кривых. Исследование этих орбит мол:ет привести к объяснению многих основных физич. и химич. свойств элементов, С точки зрения обыкновенной электродинамики непонятно, каким образом могут электроны вращаться вокруг ядра, потому что вращение есть двиление ускоренное, а всякое ускорение электрона связано с излучением энергии. Приходится поэтому искать объяснения, почему электроны не излучают энергии. Это объяснение находят в теории квант (см,), по к-рой энергия может переходить только определенными порциями, кратными некоторой основной величины, называемой квантом энергии. Скорость устойчивого движения электрона на любой орбите определяется равновесием между центробежной силой н притяжением электрона к ядру. Каждой скорости соответствует определенная энергия двилшния. Поэтому электрон в атоме не может двигаться по любой орбите, а только по таким орбитам, при которых энергия движения электрона кратна определенной величине, т, е, удовлетворяет квантовым условиям. Каждый электрон в атоме может вращаться только по определенным орбитам, при чем наиболее устойчивым движением будет то движение, которое соответствует наименьшей потенциальной энергии, т, е. орбите, наименее удаленной от ядра. Однако по каждой орбите может двигаться только ограниченное количество элщстро-нов. На первой их м, б. не более двух. Если в атоме имеется больше двух свободных электронов, то остальные должны вращаться уже по второй, более удаленной от ядра орбите. На второй орбите может вращаться не более восьми электронов. Сле-дуюпше должны попасть на третью орбиту, на к-рой может разместиться 8 электронов, на последующей 18 и т.д. Движение электронов не слишком устойчиво и по этим орбитам не является обязательным; электроны могут, под влиянием внешних воздействий, перемещаться на более отдаленные орбиты. Такое смещение электрона называется возбуждением атома, а самая орбита, на к-рую переместился электрон,- орбитой возбужденного атома. Возбулсдение атомов может происходить от самых разнообразных причин, например от воздействия на атомы электромагнитной ВОЛНЫ; т. е. видимого света или рентгеновских лучей. Слишком сильное возбуледе-ние соответствует отрыву электрона, т. е. ионизации атомов. При первом удобном случае, однако, электроны возвращаются с возбулсденных орбит к своим прежним, более устойчивым орбитам. Это перескакивание электрона с одной орбиты на другую, а следовательно уменьшштае его энергии на нек-рое количество квант, сопровождается излучением энергии. Датский физик Бор предположил, что частота v этого излучения определяется по формуле hv-W- TFi, где h - универсальная постоянная Планка (/г = 6,55.10- эрг/ск.), а Ц\ и Tfi -энергии электрона на более отдаленной (возбужденной) и на более близкой (устойчивой) орбите. Это предположение Бора блестяще
|